
Epilepsia de Precisión: Del Mosaico Clínico al Modelo que Realmente Cambia Decisiones
26 de noviembre de 2025
Neuro-Nutracéuticos y Cerebro: De los Mecanismos a la Consulta Clínica
10 de diciembre de 2025
I. Introducción
De los marcadores a las decisiones: una visión dinámica de la reserva ovárica
El nuevo reto: valorar hoy para decidir bien mañana
La postergación de la maternidad ha convertido la valoración de la reserva ovárica en una consulta recurrente. Las métricas clásicas —edad cronológica, FSH basal y recuento folicular antral (AFC)— siguen siendo útiles, pero representan fotografías estáticas: informan del contexto, no del movimiento. La hormona antimülleriana (AMH) ha ganado protagonismo como marcador de reserva funcional y predictor de respuesta a estimulación, permitiendo ajustar protocolos y dosis de gonadotropinas, evitar hiperespuestas y afinar expectativas. Aun así, usada de forma aislada no predice por sí sola resultados duros como embarazo evolutivo o nacido vivo; su potencia clínica emerge cuando se contextualiza con edad, AFC, FSH y el fenotipo metabólico-inflamatorio de la paciente (estado de resistencia a la insulina, estrés oxidativo, vitamina D, sueño y estrés).
Este artículo persigue tres metas prácticas: (i) posicionar la AMH como herramienta de triaje y consejería, (ii) desarrollar un protocolo de optimización metabólica dirigido a calidad ovocitaria y receptividad endometrial, y (iii) ofrecer una guía operativa con ventanas temporales, biomarcadores de seguimiento y criterios de escalada/derivación.
II. Protocolo clínico
Diagnosticar con precisión, intervenir con intención
Pilar 1. AMH como punto de partida (diagnóstico de precisión)
AMH en contexto: lo que dice, lo que no y cómo usarla mejor
Qué mide realmente y qué no debemos sobreinterpretar. La AMH refleja con solvencia el pool de folículos en crecimiento y predice la respuesta a gonadotropinas. Es especialmente valiosa para planificar protocolos antagonistas, considerar desencadenamiento con agonista de GnRH en altas respondedoras y reducir el riesgo de OHSS. No obstante, su capacidad pronóstica para nacido vivo es modesta cuando se utiliza sola; su lectura debe integrarse en un panel (edad, AFC, FSH y fenotipo clínico) y traducirse en un plan de acción en lugar de un veredicto.
Estandarización de la medición para decisiones estratégicas. Cuando la AMH va a condicionar preservación o cambios de protocolo, conviene fijar laboratorio y método, registrar horario/ayuno y medicación concomitante, y evitar comparaciones entre métodos distintos. Este pequeño “circuito” reduce la variabilidad inter-laboratorio y da fiabilidad a las decisiones.
Sesgos modificables antes de pinchar.
- Anticonceptivos hormonales combinados (CHC). Reducen de forma reversible AMH y AFC; tras suspenderlos, la recuperación es rápida y clínicamente relevante (habitualmente en torno a 8 semanas). Si el valor va a condicionar decisiones mayores (p. ej., congelación ovocitaria), siempre que sea seguro, es razonable programar la medición tras una corta ventana de lavado.
- Vitamina D. Existe asociación positiva entre 25-OH-D y AMH; corregir el déficit antes de decisiones críticas es sensato y permite una reevaluación a 8–12 semanas.
- Entorno metabólico e inflamatorio. IMC elevado, tabaquismo y sedentarismo pueden acompañarse de AMH más baja; no “etiquetar” sólo con el número si el terreno es optimizable.
Antes de pinchar, corrige: cómo obtener una AMH basal fiable
- Confirmar CHC activos y, si es clínicamente posible, plantear lavado ~8 semanas.
- Cribar y corregir 25-OH-D, planificando una revaluación en 8–12 semanas si la cifra es decisiva.
- Interpretar en panel (AMH + edad + AFC + FSH + fenotipo SOP/IR/IMC) y ajustar expectativas al objetivo (gestar ahora, optimizar y reevaluar, o preservar).
De tramo AMH a plan clínico: ventana de optimización o derivación temprana
Rangos orientativos (ng/mL); individualizar por edad y laboratorio. Si hubo CHC o déficit de vitamina D, considerar el lavado/corrección antes de tomar decisiones.
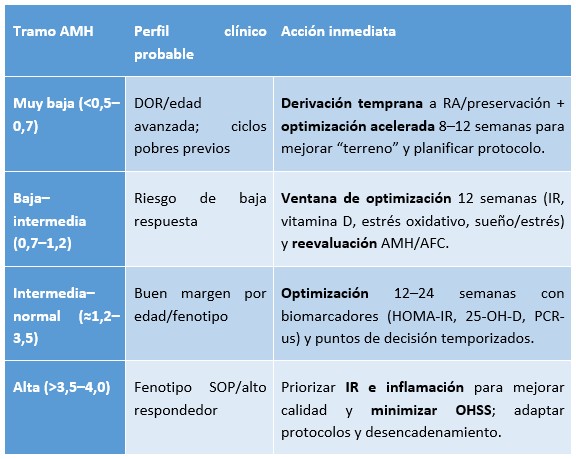
Cómo elegir la duración de la ventana.
- ≤12 semanas: AMH muy baja o edad >38–40 con objetivo de gestación a corto plazo; necesidad de respuesta rápida o HOMA-IR alto/25-OH-D muy baja que pueden corregirse pronto.
- 12–24 semanas: AMH baja-intermedia o intermedia con margen temporal; objetivo de ganar calidad ovocitaria y receptividad reduciendo comorbilidad metabólica.
Pilar 2. Optimización metabólica (intervención personalizada)
Metabolismo primero: cuando el entorno impulsa la reproducción
Ovocito mitocondrial: por qué el terreno importa
El ovocito es la célula más mitocondrial del organismo; la hiperglucemia intermitente, la lipotoxicidad y el exceso de ROS erosionan maduración, euploidía y competencia embrionaria. El endometrio comparte esta sensibilidad: en PCOS se ha descrito resistencia a insulina endometrial con alteraciones de GLUT4 y receptividad, lo que conecta la IR con fallo de implantación. Por tanto, actuar sobre IR, estrés oxidativo y bioenergética antes (o durante) RA es fisiopatológicamente coherente y clínicamente razonable.
De la teoría al prospecto: dosis, selección y precauciones
Rangos orientativos para adultas; ajustar a IMC, función hepatorrenal y medicación concomitante. Monitorizar adherencia y tolerabilidad.
1) Control de resistencia a la insulina (IR)
- Estilo de vida: patrón antiinflamatorio de baja carga glucémica (25–30 g/d de fibra, verduras, grasas de calidad) y ejercicio mixto (150–300 min/sem aeróbico + fuerza 2–3 días).
- Myo-/D-chiro-inositol (MI/DCI): consistentes mejoras metabólicas y ovulación en subgrupos; para resultados “duros” (gestación/nacido vivo) la evidencia es heterogénea. Útiles cuando se prioriza seguridad/tolerancia o la metformina no se acepta bien. Dosis frecuentes: MI 2 g cada 12 h (4 g/d) ± DCI 50–100 mg/12 h (ratio 40:1 en SOP clásico).
- Metformina (selección fenotípica): SOP con IR marcada/IMC elevado o alto riesgo de OHSS; 1700–2000 mg/d en tomas repartidas, titular por tolerancia y vigilar B12. En IVF/ICSI puede reducir OHSS y mejorar algunos desenlaces clínicos en subgrupos con IMC elevado; el efecto sobre nacido vivo es variable.
2) Estrés oxidativo e inflamación
- Coenzima Q10 (CoQ10): en edad avanzada/DOR se asocia con mejora de ovocitos MII, calidad embrionaria y, en algunos estudios, tasas clínicas; estándar nutracéutico de soporte bioenergético. 200–300 mg/día (preferentemente con comidas grasas). Precaución con anticoagulantes.
- N-acetilcisteína (NAC): metaanálisis señalan mejora ovulatoria/embarazo en PCOS y reducción de andrógenos; especialmente útil cuando coexisten IR y estrés oxidativo o la metformina no es bien tolerada. 600 mg cada 8–12 h (1.200–1.800 mg/d). Evitar combinación con nitroglicerina.
- Ácido α-lipoico (ALA): mejora sensibilidad a insulina y marcadores oxidativos; 600 mg/día (300 mg/12 h). Puede sinergizar con MI en algunos ECA.
- Vitamina D: objetivo 25-OH-D 30–50 ng/mL; pautas de 2.000–4.000 UI/día (o carga según nivel) y reevaluación a 8–12 semanas.
3) Soporte mitocondrial ovárico
- CoQ10, como arriba, con el mayor respaldo clínico actual.
- PQQ: prometedora en modelos animales (biogénesis, restauración ovárica), pero sin ECA en humanas. Si alguna paciente demanda abordajes exploratorios, debe considerarse fuera de indicación, con consentimiento informado y priorizando CoQ10 como base.
Sueño, estrés y ambiente: los “cofactores” que inclinan la balanza
El sueño insuficiente y la mala calidad (cribado con PSQI) se asocian a peores desenlaces de fertilidad/IVF en parte de la literatura, aunque con heterogeneidad; establecer objetivos de 7–9 h y un plan de higiene del sueño en la ventana peri-punción es razonable. El distrés impacta la experiencia y la adherencia; programas mind-body mejoran el malestar, aunque su efecto sobre tasas de IVF es variable. La contaminación por partículas finas (PM2.5/PM10) en días clave (estimulación avanzada, punción, transferencia) se ha vinculado a peor nacido vivo en algunas cohortes contemporáneas; conviene minimizar exposición (monitor local, ventilar, filtrar y evitar picos).
Seguimiento en 12 semanas: biomarcadores y puntos de decisión
- Metabólico: HOMA-IR y, si aplica, HbA1c, más perfil lipídico para riesgo cardiometabólico (especialmente en PCOS).
- Inflamación: PCR-us (interpretación contextual) y ferritina si procede.
- Micronutrientes: 25-OH-D a objetivo (30–50 ng/mL) antes de la siguiente gran decisión.
- Ginecológico: AFC como priorizable si el presupuesto es limitado; re-AMH cuando ha habido cambios (p. ej., suspensión de CHC o corrección sustancial de vitamina D) o se necesita objetivar respuesta del “terreno”.
- Conductual: PSQI y escala breve de estrés percibido; si el sueño no mejora pese a intervención, derivación a medicina del sueño antes de RA.
- Hitos temporales: 8–12 semanas como primer corte; extensión a 24 semanas si hay progreso objetivo y margen temporal.
III. Conclusiones y aplicabilidad clínica
De contador de folículos a gestor de salud reproductiva
Fertilidad modulable: del dato aislado al resultado clínico. La AMH ofrece el mapa (estratifica, ordena tiempos, evita errores de protocolo), pero la optimización metabólica —IR, ROS/estado inflamatorio y soporte mitocondrial— es el vehículo que puede cambiar el pronóstico, especialmente en baja reserva y edad avanzada. La clave es traducir la cifra en un plan temporizado, con biomarcadores intermedios y criterios de escalada.
Consejería que empodera, protocolos que previenen errores. Comunicar que los CHC pueden subestimar la reserva y que la recuperación tras suspensión es rápida evita etiquetar prematuramente. Integrar sueño/estrés y exposición ambiental en la ventana peri-punción añade precisión. En PCOS con IR marcada/IMC elevado, metformina es una opción sólida (incluida su utilidad para reducir OHSS); inositoles son valiosos cuando se prioriza tolerancia y mejora metabólica moderada. En DOR/AMA, CoQ10 es hoy el estándar nutracéutico.
Ensayos que importan: medir nacido vivo tras intervenir el metabolismo. Es prioritario evaluar, en ECA combinados, la suma de dieta/ejercicio + inositoles o metformina según fenotipo + antioxidantes (CoQ10) y medidas de sueño/ambiente, con nacido vivo como desenlace principal.
Referencias (Vancouver)
- Russell N, Gilmore A, Roudebush WE. Clinical utilities of Anti-Müllerian Hormone. J Clin Med. 2022;11(23):7209.
- Practice Committee of the American Society for Reproductive Medicine. Testing and interpreting measures of ovarian reserve: a committee opinion. Fertil Steril. 2020;114(6):1151-7.
- Moolhuijsen LME, Visser JA. Anti-Müllerian hormone and ovarian reserve: update and perspectives. J Clin Endocrinol Metab. 2020;105(11):3361-73.
- Landersoe SK, et al. Ovarian reserve markers after discontinuing long-term combined oral contraception: recovery over time. Reprod Biomed Online. 2020;40(1):176-86.
- Bernardi LA, et al. Duration, recency and type of hormonal contraceptive use in relation to AMH levels. Am J Obstet Gynecol. 2021;225(5):S878-9.
- Subramanian A, et al. Association between serum 25-OH-vitamin D and AMH in infertile women. Fertil Steril. 2024;121(3):607-15.
- Teede HJ, et al. 2023 International evidence-based guideline for the assessment and management of PCOS. J Clin Endocrinol Metab. 2023;108(10):2447-57.
- Fitz V, et al. Inositol for PCOS: a systematic review and meta-analysis to inform clinical practice. J Clin Endocrinol Metab. 2024;109(6):1630-48.
- Wu Y, et al. Metformin and IVF/ICSI outcomes in women with PCOS: a systematic review and meta-analysis. JAMA Netw Open. 2020;3(8):e2011995.
- Lin G, et al. Coenzyme Q10 pretreatment in diminished ovarian reserve undergoing IVF/ICSI: systematic review and meta-analysis. Ann Med. 2024;56(1):2389469.
- Liu J, et al. Effects of N-acetylcysteine on reproductive and metabolic parameters in PCOS: systematic review and meta-analysis. Front Nutr. 2023;10:1209614.
- Abu-Zaid A, et al. Alpha-lipoic acid and reproductive-metabolic outcomes in PCOS: a systematic review and meta-analysis. Nutrients. 2023;15(23):4966.
- Lei R, et al. Insulin resistance and female infertility: mechanisms and clinical implications. Front Endocrinol (Lausanne). 2024;15:1288326.
- Palomba S, et al. PCOS, hyperandrogenism, insulin resistance and endometrial receptivity: an updated review. Reprod Biomed Online. 2024;49(2):211-29.
- Leathersich SJ, et al. Particulate air pollution at oocyte retrieval and live birth rates after frozen embryo transfer. Hum Reprod. 2025;40(1):110-20.
- Pamfilio LS, et al. Does sleep quality affect IVF outcomes? A systematic review. Sleep Med Rev. 2025; (ahead of print).
