
Epigenética en la Práctica Clínica: Cómo los Hábitos Modulan la Expresión Génica
19 de noviembre de 2025
Fertilidad de Precisión: De la Cifra Estática al Plan Clínico que Cambia El Pronóstico
3 de diciembre de 2025
Revisión basada en: Morita-Sherman M, Trinka E, Kwan P, Ikeda A, Cho M, Hampel H. Precision medicine for epilepsy: challenges and perspectives for an optimized clinical care pathway. Frontiers in Neurology, 11 de septiembre de 2025. Frontiers
Epilepsia: un diagnóstico paraguas que exige otra forma de pensar
Dos pacientes con crisis tónico-clónicas pueden parecer idénticos en la consulta y, sin embargo, esconder causas biológicas y trayectorias clínicas radicalmente distintas. La revisión de Morita-Sherman y colaboradores parte de una idea sencilla y poderosa: la epilepsia no es una sola enfermedad, sino un espectro complejo y dinámico. Por eso, el cambio de paradigma no consiste en “personalizar” por preferencia o comodidad, sino en precisar según la biología que sostiene cada caso. Ese es el núcleo de la medicina de precisión aplicada a epilepsia (PM, por sus siglas en inglés): prevenir, diagnosticar y tratar teniendo en cuenta la variabilidad individual y la heterogeneidad del espectro.
Lo que aprendimos de la oncología (y lo que no debemos copiar sin matices)
La oncología allanó el camino: grandes cohortes, múltiples “ómicas”, datos normalizados, herramientas computacionales y biomarcadores que guían decisiones terapéuticas. Ese ecosistema permitió pasar del “citotóxico para todos” a terapias dirigidas por diana. Epilepsia aspira a recorrer una ruta semejante, pero con diferencias clave: no siempre podemos acceder a tejido enfermo, las mediciones de resultado dependen a menudo de recuentos de crisis (subjetivos e intermitentes) y los biomarcadores pueden ser epifenómenos de redes neuronales complejas, no simples “interruptores” etiológicos. Asumir esa complejidad no es frenar: es elegir mejor el mapa para llegar a destino.
Cuatro motores del cambio: biomarcadores, imagen/EEG, salud digital, ciencia de datos
El artículo propone un andamiaje práctico para avanzar, articulado en cuatro ejes que se refuerzan entre sí:
- Biomarcadores
- Tecnologías de medición clínica (neuroimagen y electrofisiología avanzadas)
- Salud digital (datos continuos del mundo real)
- Ciencia de datos y medicina de sistemas (integración multimodal, IA, modelos normativos)
Cuando estos elementos se combinan, dejan de ser “capas sueltas” para convertirse en un modelo integrador que explica mejor la epilepsia de cada persona y predice su respuesta a las intervenciones.
Biomarcadores que sí cambian decisiones
Qué son y por qué importan. Biomarcadores válidos conectan la fisiopatología con el manejo clínico. En epilepsia, no buscamos un único marcador “mágico”, sino firmas combinadas que indiquen susceptibilidad, diagnóstico, pronóstico, respuesta al tratamiento, seguridad e, idealmente, predicción de beneficio. La revisión subraya que la aportación real emerge cuando integramos genética, neuroimagen, electrofisiología y fluidos biológicos en paneles que operan como un todo.
Genética clínica. Entre el 70–80% de las epilepsias tendrían variantes con peso etiopatogénico. Paneles de genes, exoma o genoma han identificado centenares de genes vinculados a formas mono- y poligénicas. Aun con pleiotropía y heterogeneidad (un mismo gen con fenotipos diversos, síndromes clínicamente similares con bases genéticas distintas), la senda es clara: cuanto antes identifiquemos la biología, antes evitaremos fármacos contraindicados, elegiremos dianas plausibles o indicaremos dietas terapéuticas específicas (p. ej., déficit de GLUT1). En suma, el diagnóstico molecular no es un “lujo académico”: es un acelerador de decisiones.
Fluidos y señal de red. A diferencia del cáncer, en epilepsia los biomarcadores de fluidos (sangre/LCR) y los derivados de redes (EEG avanzado) pueden reflejar estados funcionales más que causas fijas. Lejos de restarles valor, esto invita a usar paneles: combinar, por ejemplo, una firma inflamatoria con rasgos electrográficos y un fenotipo clínico para estratificar riesgo o refractariedad. Esa mirada multimodal mejora la inferencia clínica frente a la lectura aislada de cada prueba.
Neuroimagen y electrofisiología: ver lo invisible, medir la red
Neuroimagen cuantitativa. Pasamos de “buscar lesiones” a cuantificar desviaciones del patrón esperado usando modelos normativos y conectómica. La MRI de difusión, fMRI, SPECT o PET, integradas con herramientas computacionales, detectan alteraciones sutiles de sustancia gris/blanca y desacoples de red que la inspección visual puede pasar por alto. Este salto no es cosmético: reorienta decisiones (p. ej., candidatos a cirugía o neuromodulación) y refina pronóstico.
EEG más allá de la rutina. El EEG clínico seguirá siendo columna vertebral, pero su potencia crece al aumentar densidad de electrodos, mejorar la resolución temporal y aplicar análisis de conectividad. Cuando EEG, MRI y clínica se alinean en un mapa de red, el equipo puede decidir con mayor seguridad qué ajustar (fármacos), qué modular (VNS/DBS/RNS) o cuándo derivar.
Salud digital: datos continuos para decisiones dinámicas
La revisión enfatiza un punto táctico: los resultados basados en recuento de crisis son imperfectos (episodicidad, subregistro, dependencia del relato del cuidador). Por eso, integrar mediciones digitales —desde detección de convulsiones hasta métricas de sueño/actividad— reduce ruido y aporta continuidad entre visitas. Más allá de la alerta puntual, estos datos permiten:
- Curvas de respuesta realistas tras iniciar o ajustar un fármaco.
- Patrones temporales (semana/día/noche) que ayudan a personalizar horarios y dosis.
- Endpoints pragmáticos en estudios clínicos con vida real.
No se trata de coleccionar gadgets, sino de cerrar el circuito asistencial: indicación adecuada, educación, umbrales de acción y revisión periódica del valor añadido para ese paciente concreto.
Ciencia de datos y medicina de sistemas: del dato suelto a la predicción clínica
La PM en epilepsia despega cuando los datos dejan de vivir en silos. La revisión apunta a tres palancas:
- Integración multimodal a escala (clínica, genética, imagen, EEG, digital-ómics).
- Modelos explicables que conecten señales con mecanismos (evitando “cajas negras” cuando las decisiones son trascendentes).
- Colaboración multicéntrica con políticas de interoperabilidad, desidentificación y aprendizaje federado para proteger la privacidad y a la vez aprender de grandes números de casos.
El resultado esperado no es otra “escala de riesgo”, sino modelos que subtipan, predicen y simulan: ¿quién responderá a qué ASM?, ¿quién se beneficia antes de una derivación a cirugía o neuromodulación?, ¿qué trayectoria clínica cabe esperar si intensificamos el plan hoy y no dentro de seis meses? Esta es la promesa pragmática de la PM: decisiones más tempranas, más justificadas y más revisables.
De la etiqueta al biotipo tratable: un mapa clínico-biológico para avanzar
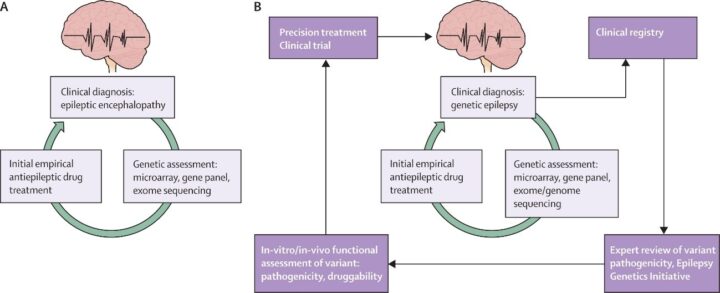
La ILAE nos dio un lenguaje común para describir crisis y síndromes. La PM propone añadir capas: mecanismos genéticos/metabólicos, firmas de imagen y EEG, factores inmunes y ambientales, y datos de vida real. Así, la pregunta cambia de “¿qué tipo de crisis es?” a “¿qué biotipo de epilepsia tengo delante y qué palancas terapéuticas son plausibles para ese biotipo?”. Este giro habilita cuatro dimensiones P4:
- Predictiva: estimar quién evolucionará a refractariedad o quién responderá a neuromodulación.
- Preventiva: intervenir antes en quienes acumulan riesgo (p. ej., crisis nocturnas con comorbilidades de sueño).
- Personalizada: ajustar el plan más allá de la etiqueta sindrómica, según firmas de red y dianas.
- Participativa: compartir métricas comprensibles con el paciente para cocrear el plan terapéutico.
Qué significa “implementarlo mañana” en un servicio real
- Solicitar genética antes, no después. En epilepsias no explicadas —sobre todo inicio temprano, refractariedad o fenotipos sindrómicos— la genética acorta el ensayo-error y evita decisiones iatrogénicas (p. ej., bloquear canales de sodio en síndromes sensibles).
- Estandarizar la imagen cuantitativa. Protocolos 3T, difusión y modelos normativos elevan la sensibilidad para alteraciones sutiles y reorientan casos quirúrgicos/funcionales.
- Elevar el listón del EEG. Mayor densidad, análisis de conectividad y correlación con clínica e imagen desvelan redes que guían el plan (fármaco, estimulación, derivación).
- Capturar datos entre visitas. Herramientas digitales con objetivos claros (detección de convulsiones, sueño, adherencia) crean curvas de respuesta accionables y endpoints útiles en investigación.
- Medir lo que hacemos. Migrar de “número de fármacos probados” a tiempo hasta respuesta, reducción de urgencias/hospitalizaciones y calidad de vida. Solo lo que se mide, mejora.
Horizonte cercano: IA clínica, aprendizaje federado y resultados que importan
La madurez de la PM no llegará de un “súper marcador”, sino de sinergias. A medida que mejore la validación de biomarcadores y la calidad/continuidad de los datos digitales, la IA podrá predecir trayectorias útiles (por semanas y no solo por años) y ayudar a simular escenarios de tratamiento, siempre con salvaguardas éticas y auditabilidad. El camino pasa por redes multicéntricas que compartan conocimiento sin comprometer la privacidad, y por políticas sanitarias que faciliten cobertura a pruebas y servicios digitales con impacto demostrado. La meta no es tecnológica, es humana: menos carga de crisis, mejor vida diaria y menor coste social.
Conclusión: precisión no es promesa vacía, es método verificable
La medicina de precisión en epilepsia ya no es un deseo, es un proceso en marcha: identificar biología relevante, medir redes y resultados con mayor fidelidad, integrar datos con rigor y revisar el plan con la misma frecuencia con que cambia la enfermedad. No todo será inmediato —la heterogeneidad del espectro y las limitaciones de medida lo recuerdan—, pero ya disponemos de una hoja de ruta razonable para acelerar decisiones correctas y reducir años de incertidumbre. El siguiente salto no dependerá de una herramienta milagrosa, sino de equipos clínicos capaces de integrar genética, imagen, EEG, datos de vida real y análisis computacional en beneficio del paciente. Ese es el estándar hacia el que debemos movernos.
Bibliografía
Morita-Sherman M, Trinka E, Kwan P, Ikeda A, Cho M, Hampel H. Medicina de precisión para la epilepsia: desafíos y perspectivas para una vía de atención clínica optimizada. Frente Neurol. 11 de septiembre de 2025;16:1644835. doi: 10.3389/fneur.2025.1644835. PMID: 41018203; PMCID: PMC12460136.
