
Autismo y Neurología de Precisión: Nuevos Hallazgos para un Enfoque Personalizado
8 de octubre de 2025 Dra. Yaima González Paredes
Dra. Yaima González Paredes
La menopausia representa un punto en el recorrido de etapas de la vida de las mujeres, marcando el final de la etapa reproductiva. Este proceso es experimentado en la mayoría de las féminas entre los 45 y 55 años. Históricamente, la menopausia se asociaba con el fin de la capacidad reproductiva femenina y, en algunas culturas, con la pérdida de atractivo o valor social, situación que ha cambiado para bien, porque la sociedad ha cambiado, porque la mujer ha cambiado y actualmente a esas edades aún nos sentimos jóvenes, creativas, con una capacidad de desarrollo profesional significativo y generalmente nos enfocamos más en objetivos personales.
La menopausia no debe verse como patológica, ni como el fin de nada, sino como una transición hacia una nueva etapa de nuestras vidas, que, teniendo en cuenta el aumento de la esperanza de vida actual, hace que las mujeres vivamos el mayor tiempo de nuestra existencia con la menopausia y los riesgos que esta conlleva. Por lo tanto, es nuestro deber y el de la sociedad el poder transformar la Menopausia en ¨Plenopausia¨ y contribuir al renacimiento de la mujer del siglo XXI en esta nueva etapa de su vida.
Y como había mencionado no es una patología, pero nos hace ser más vulnerables y también nos enferma y nos deteriora nuestra calidad de vida y la de nuestro entorno.
Los síntomas asociados a la menopausia y a la transición premenopáusica son muy bien conocidos y también sabemos que están asociados a la pérdida de la función folicular de los ovarios y la disminución de los estrógenos.
Unas mujeres lo sufren más que otras, pero todas sabemos lo que nos puede pasar por estos cambios hormonales: sofocos, inestabilidades emocionales, problemas al dormir, aumentamos de peso en grasa asociado con alteraciones metabólicas, mayor riesgo cardiovascular y osteoporosis, entre otros.
Todos sabemos y culpamos a los estrógenos de este caos sistémico, pero no es de tanto conocimiento general de que también hay una afectación significativa, aunque no tan abrupta de la testosterona, hormona no tan abundante en la mujer, pero igualmente importante, sin embargo, al no considerarse que existe un “corte” en la producción como en el Estradiol, no se toma igualmente en cuenta en esta etapa.
Y es que ambas hormonas juegan un papel fundamental en orquestar unas organelas maravillosas: nuestras ¨Mitocondrias¨, sí, de nuevo ¨mitocondrias¨, sufriendo ellas también su propio declive hormonal, al que le he llamado ¨Mitopausia¨. Y es por eso que el mejor momento para prepararnos para la menopausia es a partir de los 25 o 30 años, cuando aun tenemos un colágeno perfecto, pero ya puede comenzar el declive mitocondrial.
Estrógenos y Mitocondrias:
Muchas de las vías de señalización de estrógenos propuestas convergen en este orgánulo y también por eso existen diferencias entre las mitocondrias femeninas y masculinas, como también mostramos diferencia antioxidante con respecto a los hombres, al producir menos radicales libres y a su vez menor daño oxidativo.
Se han propuesto varios mecanismos, que nos hace pensar si realmente las mujeres sufrimos una injusticia biológica con la menopausia o sencillamente una privación radical de lujos con los que contamos siempre.
- Se ha reportado que las mitocondrias femeninas generan la mitad de peróxido de hidrógeno que las masculinas porque presentan niveles más altos de glutatión reducido mitocondrial.
- El Estradiol aumenta las proteínas antioxidantes: Superóxido dismutasa 1 (SOD1), la superóxido dismutasa 2 (SOD2) y la glutatión peroxidasa (GPx).
- Nuestras mitocondrias presentan una mayor capacidad de retención de Ca2+, teniendo una mayor capacidad de regulación de los niveles de este ion y con ello mejor contracción – relajación cardíaca. El calcio y su acumulación en la matriz mitocondrial juega un papel importante en la regulación de la producción del ATP.
- El receptor de estrógeno acoplado a proteína G (GPER), modula los ROS al disminuir la NADPH oxidasa 4 (NOX4) y la prostaglandina- endoperóxido sintasa 2 (PTGS2), ambos precursores de ROS.
- Así mismo los GPER aumentan proteínas antioxidantes, como la sirtuina 3 (SIRT3), relacionada con la prevención del envejecimiento y las enfermedades relacionadas con la edad, por lo tanto, asociada a la longevidad y la glutatión S-transferasa kappa 1 (GSTK1), enzima que pertenece a la familia de las Glutation transferasas (GST), con funciones de desintoxicación celular tanto de compuestos externos como internos.
- GPER también ejerce efectos antiinflamatorios al disminuir la expresión de interleucina (IL)-6 en macrófagos mediante la supresión de la actividad del factor nuclear κB (NF-κB)
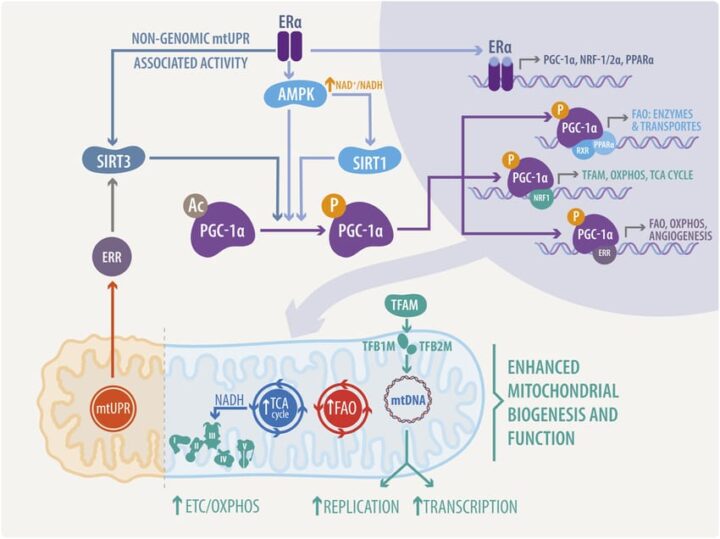
- Estradiol regula positivamente la sirtuina 1 (SIRT1), implicada en la regulación de la senescencia celular y la longevidad, ya que tiene un papel fundamental en la homeostasis metabólica (betaoxidación y sensibilidad a la insulina) y actúa como una deacetilasa de histonas, regulando la expresión genética (p53, FOXO, etc). También modula la actividad de otros fatores como PPARs y PGC-1α.
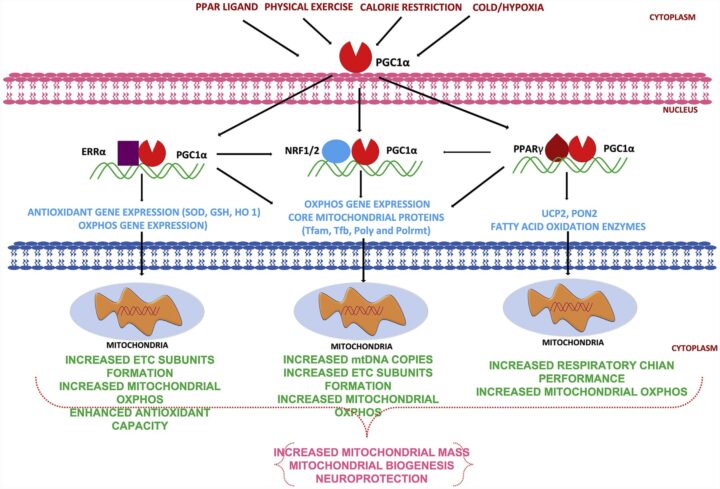
- El coactivador del receptor activado 1 alfa (PGC-1α), la proteína quinasa activada por AMP (AMPK), ambos claves en la biogénesis mitocondrial, el metabolismo oxidativo y los mecanismo en respuesta al estrés oxidativo mitocondrial y varios genes implicados en la cadena de transporte de electrones, están regulados por hormonas sexuales y, más específicamente, por la señalización estrogénica.
- PGC1-α ejerce una influencia considerable sobre los factores de transcripción NRF1 y NRF2, ambos implicados en la respuesta al estrés oxidativo y la biogénesis mitocondrial, promoviendo la expresión y actividad de ambos factores. La expresión de NRF1, un gen con un elemento de respuesta a estrógenos (ERE), se relaciona con la producción de energía y a la protección contra el daño oxidativo. NRF2, junto con otros factores de transcripción, induce la expresión de genes que codifican proteínas antioxidantes y enzimas de detoxificación, protegiendo a la célula de los daños causados por los radicales libres. La activación de Nrf2 puede ayudar a defender contra el deterioro cognitivo, especialmente en condiciones como la enfermedad de Alzheimer.
- La activación de GPER y ERα preserva la función mitocondrial y disminuye la mitofagia tras una lesión por isquemia – reperfusión (I/R) mediante una señalización dependiente del poro de transición de la permeabilidad mitocondrial (MPTP).
- Las mitocondrias con mayor influencia estrogénica presentan mayores niveles de fosforilación de la aldehído deshidrogenasa 2 (ALDH2), enzima crucial para proteger las células del estrés oxidativo y el daño celular. Juega un papel fundamental en el metabolismo del alcohol, al transformar el acetaldehído en ácido acético que es menor perjudicial ¿Has notado que con estos cambios hormonales puedes tener mayor enrojecimiento facial, náuseas, mareos y otros síntomas no muy agradables tras la misma ingesta de alcohol que podías hacer antes?
- Los corazones femeninos contamos con un aumento en la fosforilación de la alfa-cetoglutarato deshidrogenasa (αKGDH), enzima que cataliza la conversión de α- cetoglutarato en succinil- CoA, liberando CO2 y generando NAD, por lo tanto, es un punto clave en el metabolismo energético.
Los estrógenos pueden unirse a los RE nucleares y de membrana, con diferentes afinidades para cada receptor y la intensidad de la respuesta asociada, mediando sus efectos biológicos en diferentes tejidos.
Existen dos subtipos principales de RE: RE alfa (ERα) y RE beta (ERβ). Estos receptores difieren en su distribución tisular y funciones, regulando la expresión de diferentes genes y efectos fisiológicos.
-
RE alfa (Erα o ESR1): Este receptor se expresa en una amplia variedad de tejidos, incluyendo el útero, las glándulas mamarias y el sistema nervioso central. Desempeña un papel importante en la regulación de la función reproductiva, la homeostasis del calcio y el crecimiento celular.
-
RE beta (Erβ o ESR2): Este receptor se expresa principalmente en el corazón, el cerebro, el sistema inmunológico y el tejido óseo. Tiene un papel importante en la regulación de la presión arterial, la inflamación y la función del sistema inmunológico.
-
GPR30: (“G-protein coupled estrogen receptor”): Este receptor, también conocido como receptor de estrógeno acoplado a proteínas G, se encuentra en la membrana celular y juega un papel en la señalización intracelular.
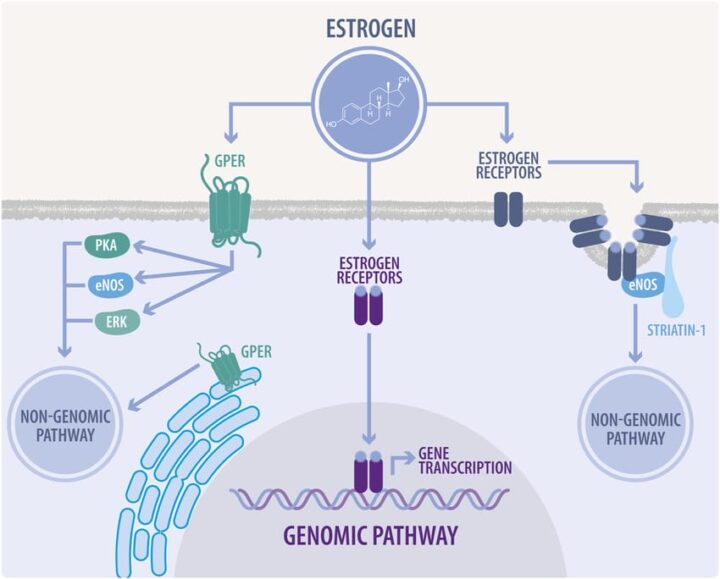
La acción celular de los estrógenos se produce a través de vías genómicas (clásicas) y no genómicas (no clásicas), de esta última manera, actuando como segundos mensajeros que conectan el núcleo y las mitocondrias, sin la participación del núcleo, por ejemplo, uniéndose a receptores de membrana como los GPCR, que a la vez induce una amplificación de la señal a otros segundos mensajeros, como el AMPc y el GMPc.
Testosterona y Mitocondrias
La investigación actual sugiere que la testosterona influye en las mitocondrias de varias maneras:
- También la testosterona puede estimular la expresión de genes implicados en la biogénesis mitocondrial, como PGC-1 alfa, promoviendo la biogénesis mitocondrial y a su vez puede mejorar la capacidad de resistencia y la eficiencia metabólica de los músculos.
- Modulación de la Cadena de Transporte de Electrones (CTE) y Producción de ATP, influyendo en la actividad de los complejos de la CTE optimizando la eficiencia de la fosforilación oxidativa y, por ende, la producción de ATP
- En concentraciones fisiológicas, protege contra la apoptosis inducida por H2O2, que se relaciona con disfunción mitocondrial, por lo que media efectos protectores frente al daño oxidativo en el músculo esquelético y su relación con miopatías asociadas al déficit hormonal. También se ha descrito que puede influir en la actividad de enzimas antioxidantes mitocondriales, protegiendo a las mitocondrias del daño causado por especies reactivas de oxígeno (ROS).
- La testosterona provoca un aumento de la proteína de choque térmico 90 (Hsp90), que participa en la eliminación de proteínas dañadas o innecesarias y garantizando que se transmitan señalizaciones correctas. Aunque reside principalmente en el citoplasma, su homólogo TRAP1 se encuentra intramitocondrial, participando en el control de la calidad de las proteínas mitocondriales.
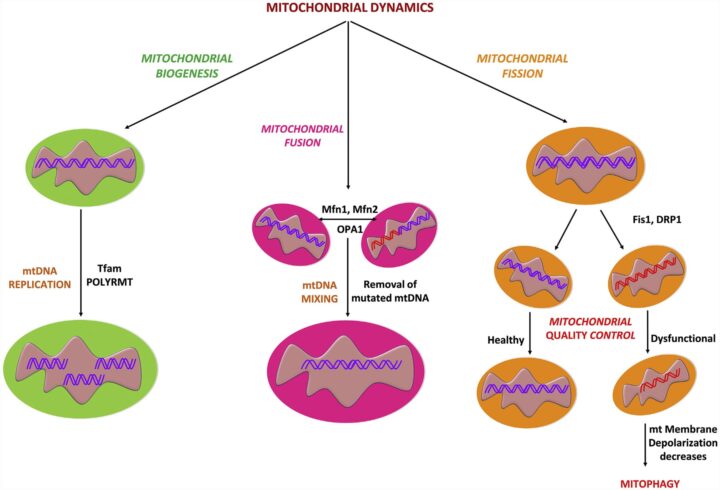
- La testosterona podría modular el equilibrio entre los procesos implicados en la dinámica mitocondrial: fusión y fisión, lo cual es vital para mantener la calidad y función mitocondrial y el impacto sistémico que se asocia a ello.
- Influencia en el metabolismo energético: al regular la composición corporal (aumento de masa muscular, reducción de masa grasa), la testosterona afecta indirectamente el metabolismo de la glucosa y los lípidos, impactando la disponibilidad de substratos para las mitocondrias y su eficiencia energética al influir en la tasa metabólica basal. Se asocia con la mejoría de la sensibilidad a la insulina, optimizando así la homeostasis de la glucosa y al favorecer la recomposición corporal adecuada, la salud ósea y la fuerza muscular, mejora la beta oxidación al ser una hormona anabólica. Su reducción posmenopáusica podría contribuir a estos riesgos metabólicos.
Aunque menos estudiado que en hombres, la testosterona tiene efectos neuro protectores. La disfunción mitocondrial cerebral se asocia con el deterioro cognitivo, y la caída de testosterona en la menopausia podría exacerbar estos cambios a través de vías mitocondriales.
Evidentemente existe mucha más información al respecto, pero esta revisión, es con el objetivo de hacer énfasis cada vez más en la necesidad de cuidar de nuestras hormonas incluso cuando aún no estén afectadas y que una manera muy integral y no siempre tomada en cuenta, es desde jóvenes evitar el daño mitocondrial adquirido, dígase por inflamación sistémica de bajo grado, inflamación, toxicidad endógena o medioambiental, etc.
Enfocar la menopausia como mitopausia, permite proponer un modelo de estudio y abordaje integrativo y de acción sistémica que vaya más allá del aporte de tratamiento de reemplazo hormonal y le atribuye a los estrógenos y a la testosterona una función más allá del ciclo reproductivo y más allá del deseo sexual, aun en mujeres que no tengan síntomas comunes como sofocos y sequedad vaginal, disminución de la libido y pone el foco de atención en su potencial impacto en la energía y el metabolismo y su efecto global en el organismo.
El saber cuidar de nuestras mitocondrias, aun cuando todavía no nos lo pidan a gritos, es el camino más inteligente para alcanzar una vida longeva y activa. Y es sin dudas, la mejor manera que conozco de transformar la menopausia en plenopausia.
